 |
 |
- Search
| Korean J Head Neck Oncol > Volume 35(1); 2019 > Article |
|
Abstract
Background/Objectives
Despite multiple approaches of treatments for salivary duct carcinoma, there has been a need for more successful treatment methods because of its poor prognosis. Treatment options like immunotherapy using new technologies have been attempted. Based on recent study results indicating that targeting programmed death receptors are effective in treating various cancers, this study aimed to identify the frequency of PD-L1 expression and its impact on survival rate in salivary duct carcinoma.
Materials & Methods
We studied 33 patients with salivary gland cancer who were available for histologic specimens. We examined the expression of PD-L1 in the tissues and analyzed the association with the survival rate and the association with various clinical parameters.
ņ╣©ņāśĻ┤ĆņĢöņØĆ ĒāĆņĢĪņäĀ ļ░░ņČ£Ļ┤ĆņØś ņāüĒö╝ņäĖĒżņŚÉņä£ ĻĖ░ņøÉĒĢśļŖö ņĢöņóģņ£╝ļĪ£ņä£, Kleinsasser ļō▒ņŚÉ ņØśĒĢ┤ 1968ļģä ņ▓śņØī ĻĖ░ņłĀļÉ£ ņØ┤Ēøä 1990ļģäļīĆņŚÉ ņŻ╝ļĪ£ ļ│æļ”¼ĒĢÖņ×ÉļōżņØś ņ×äņāüļ│æļ”¼ņĀü ņŚ░ĻĄ¼ļōżņØ┤ ļ░£Ēæ£ļÉśļ®┤ņä£ ļäÉļ”¼ ņĢīļĀżņ¦ĆĻ▓ī ļÉśņŚłļŗż[1].
2017ļģä WHO ļČäļźśņŚÉ ļö░ļź┤ļ®┤ ņ╣©ņāśņĢöņØĆ 20Ļ░£ņØś ņĪ░ņ¦üņĢäĒśĢņ£╝ļĪ£ ļČäļźśļÉśĻ│Ā ņ╣©ņāśĻ┤ĆņĢöņØĆ ņØ┤ņżæ ĒĢśļéśļĪ£ņä£ ĒāĆņĢĪņäĀņŚÉ ļ░£ņāØĒĢśļŖö ņĀäņ▓┤ ņĢģņä▒ņóģņ¢æ ņżæ 10% ļé┤ņÖĖļź╝ ņ░©ņ¦ĆĒĢśļŖö ņāüļīĆņĀüņ£╝ļĪ£ ļō£ļ¼Ė ņĢöņóģņØ┤ņ¦Ćļ¦ī, ņ×¼ļ░£Ļ│╝ ņĀäņØ┤ņØś ļ╣łļÅäĻ░Ć ļ¦ÄņØĆ Ļ│ĀņĢģņä▒ļÅäņØś ņĢöņóģņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż. ņ╣©ņāśĻ┤ĆņĢöņŚÉņä£ ņÖĖĻ│╝ņĀü ņĀłņĀ£ņłĀņØ┤ Ļ░Ćņן ņØ╝ļ░śņĀüņ£╝ļĪ£ ņäĀĒāØļÉśļŖö ņ╣śļŻīļ▓ĢņØ┤ļ®░ ņ¦äĒ¢ēļÉ£ ļ│æĻĖ░ņØś ņĢöņóģņŚÉ ļīĆĒĢ┤ņä£ļŖö ļ░®ņé¼ņäĀ ņ╣śļŻīļéś ĒĢŁņĢöĒÖöĒĢÖņÜöļ▓ĢņØä ņČöĻ░ĆļĪ£ ņŗ£Ē¢ēĒĢśĻ▓ī ļÉśņ¦Ćļ¦ī ņĀüĻĘ╣ņĀüņØĖ ņ╣śļŻīņŚÉļÅä ņśłĒøäļŖö ļ╣äĻĄÉņĀü ņóŗņ¦Ć ņĢŖņØĆ Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[2].
ņØ┤ļ¤¼ĒĢ£ ĒŖ╣ņä▒ļōżļĪ£ ņØĖĒĢ┤ ņĄ£ĻĘ╝ ņ╣©ņāśĻ┤ĆņĢöņØś ņ╣śļŻīņŚÉ ļŗżņ¢æĒĢ£ ļ░®ļ▓ĢļōżņØ┤ ņåīĻ░£ļÉśĻ│Ā ņ׳ņ£╝ļ®░ ĻĘĖ ņżæ ļīĆĒæ£ņĀüņØĖ Ļ▓āņØ┤ ĒĢŁņĢöļ®┤ņŚŁņ╣śļŻīņØ┤ļŗż. ņ╣©ņāśĻ┤ĆņĢöņØś ņĢĮ 25-90%Ļ░Ć Human epidermal growth factor receptor type 2(HER2)ļź╝ ļ░£ĒśäĒĢ£ļŗżļŖö ņé¼ņŗżĻ│╝ ņ£Āļ░®ļÅäĻ┤ĆņĢöĻ│╝ ņ╣©ņāśĻ┤ĆņĢöņØś ņĪ░ņ¦üĒĢÖņĀü ņ£Āņé¼ņä▒ņŚÉ ĻĘ╝Ļ▒░ĒĢśņŚ¼ Herceptin┬«(trastuzumab)ņØä ņØ┤ņÜ®ĒĢ£ ņ╣śļŻīļĪ£ ņ£ĀņØśļ»ĖĒĢ£ ņāØņĪ┤ņ£© ņ░©ņØ┤ļź╝ ļ░£Ļ▓¼ĒĢ£ ņŚ░ĻĄ¼ļÅä ņ׳ņŚłņ£╝ļéś ņØ╝ļČĆ ņŚ░ĻĄ¼ņŚÉņä£ļŖö Herceptin┬«(trastuzumab) ļŗ©ļÅģņ╣śļŻīĻ░Ć ņØśļ»Ėņ׳Ļ▓ī ņśłĒøäļź╝ Ļ░£ņäĀņŗ£Ēéżņ¦ĆļŖö ļ¬╗ĒĢ£ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśĻĖ░ļÅä Ē¢łļŗż[3-5]. ļśÉĒĢ£ HER2 ņØīņä▒ņØĖ ĒÖśņ×ÉĻĄ░ņŚÉ ļīĆĒĢ┤ņä£ ĻĘĖ ĒÜ©Ļ│╝ļŖö ļČłļČäļ¬ģĒĢśļŗż.
HER2ļź╝ ņØ┤ņÜ®ĒĢ£ ĻĖ░ņĪ┤ ĒĢŁņĢöļ®┤ņŚŁņ╣śļŻī ņØ┤ņÖĖņŚÉ ņĄ£ĻĘ╝ņŚÉļŖö PD-L1ņØś ļ░£ĒśäņØ┤ ņ╣©ņāśņĢöņØś ņśłĒøäņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣£ļŗżļŖö ņé¼ņŗżņØ┤ ļ│┤Ļ│ĀļÉśļ®┤ņä£ PD-1/PD-L1 Ļ▓ĮļĪ£ļź╝ ņØ┤ņÜ®ĒĢ£ ĒĢŁņĢöļ®┤ņŚŁņ╣śļŻīņŚÉ ļīĆĒĢ£ Ļ┤Ćņŗ¼ņØ┤ ņ”ØĻ░ĆļÉśĻ│Ā ņ׳ņ£╝ļ®░ ņØ╝ļČĆ ņŚ░ĻĄ¼ņŚÉņä£ļŖö PD-1ņ░©ļŗ©ĒĢŁņ▓┤ņØĖ nivolumabņØś ņ╣śļŻīĒÜ©Ļ│╝Ļ░Ć ņóģļלņØś ĒĢŁņĢöĒÖöĒĢÖņÜöļ▓Ģļ│┤ļŗż ņÜ░ņłśĒĢśļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśĻĖ░ļÅä Ē¢łļŗż[6]. ņØ┤ņŚÉ ļö░ļØ╝ PD-L1ņØä ĒĢŁņĢöļ®┤ņŚŁņ╣śļŻīļź╝ ņ£äĒĢ£ ņ░©ņäĖļīĆ ĒÖśņ×É ņäĀĒāØ Ēæ£ņ¦Ćņ×ÉļĪ£ņä£ ņØ┤ņÜ®ĒĢśļĀżļŖö ņŚ░ĻĄ¼ļÅä ĒÖ£ļ░£Ē׳ ņØ┤ļŻ©ņ¢┤ņ¦ĆĻ│Ā ņ׳ļŗż[7].
ņØ┤ņŚÉ ļ│Ė ņŚ░ĻĄ¼ļŖö ņ╣©ņāśĻ┤ĆņĢöņŚÉņä£ HER2 ļ░£ĒśäĻ│╝ PD-L1ņØś ļ░£ĒśäņØ┤ ņāØņĪ┤ņ£©ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ļČäņäØĒĢśĻ│Ā ņ╣©ņāśĻ┤ĆņĢö ĒÖśņ×Éļź╝ ņäĀļ│äĒĢśĻĖ░ ņ£äĒĢ£ ļ®┤ņŚŁĒæ£ņ¦Ćņ×ÉļĪ£ņä£ PD-L1ņØś ĒÜ©ņÜ®ņä▒ņŚÉ ļīĆĒĢ┤ņä£ ĒÖĢņØĖĒĢśĻ│Āņ×É ĒĢ£ļŗż.
2000ļģäļČĆĒä░ 2016ļģäĻ╣īņ¦Ć ņ┤Ø 36ļ¬ģņØś ĒÖśņ×ÉĻ░Ć ņ╣©ņāśĻ┤ĆņĢöņ£╝ļĪ£ ņ¦äļŗ©ļÉśņŚłĻ│Ā ņĪ░ņ¦üĒæ£ļ│ĖņØ┤ ņØ┤ņÜ® Ļ░ĆļŖźĒĢ£ 33ļ¬ģņØś ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ņŚ░ĻĄ¼ļź╝ ņ¦äĒ¢ēĒĢśņśĆļŗż. ļ¬©ļōĀ ņ╝ĆņØ┤ņŖżņŚÉņä£ ņÖĖĻ│╝ņĀü ņĀłņĀ£ņłĀņØ┤ ņŗ£Ē¢ēļÉśņŚłĻ│Ā Archived formalin-fixed, paraffin-embedded(FFPE) Ēæ£ļ│ĖņØä ĒÖĢļ│┤ĒĢśņśĆļŗż. ļ¬©ļōĀ ņé¼ļĪĆņØś ņÖĖĻ│╝ņĀü ņĀłņĀ£ņłĀņØĆ ņäĖļĖīļ×ĆņŖż ļ│æņøÉņŚÉņä£ ņŗ£Ē¢ēļÉśņŚłļŗż. ņ×äņāüļ│æļ”¼ņĀü ĒŖ╣ņ¦ĢņŚÉ ļīĆĒĢ┤ņä£ Table 1ņŚÉ ņĀ£ņŗ£ĒĢśņśĆļŗż. Seventh American Joint Committee on Cancer TNM cancer classification system and the World Health OrganizationņŚÉ ĻĘ╝Ļ▒░ĒĢśņŚ¼ ņóģņ¢æ ļ│æĻĖ░ļź╝ ĻĄ¼ļČäĒĢśņśĆļŗż. ņČöņĀüĻ┤Ćņ░░ĻĖ░Ļ░äņØś ņżæņĢÖĻ░ÆņØĆ 32Ļ░£ņøöņØ┤ņŚłĻ│Ā(range, 9 ~ 135 Ļ░£ņøö) 33ļ¬ģ ĒÖśņ×É ļ¬©ļæÉ anti HER2 ņ╣śļŻīļéś androgen deprivation ņ╣śļŻīļź╝ ņŗ£Ē¢ēļ░øņØĆ ļ░ö ņŚåņŚłļŗż. ņØ┤ ņŚ░ĻĄ¼ļŖö Institutional Review Board of Severance Hospital(4-2016-1049)ņØś ņŖ╣ņØĖ ĒĢśņŚÉ ņ¦äĒ¢ēļÉśņŚłļŗż.
TMA(tissue microarray) ĻĄ¼ņä▒ņØä ņ£äĒĢ┤ ņóģņ¢æ ņĪ░ņ¦üņŚÉņä£ 1-3Ļ░£ņØś ļīĆĒæ£ņĀüņØĖ Ēæ£ļ│ĖņØä ņ▒äņĘ©ĒĢśņśĆļŗż. ņĪ░ņ¦üņ▒äņĘ©ļź╝ ņ£äĒĢ£ ĻĖ░ĻĄ¼(trephine apparatus)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ 3mm ņ¦üĻ▓ĮņØś ņżæņŗ¼ņĪ░ņ¦üņØä ņ▒äņĘ©ĒĢśņŚ¼ TMA ļĖöļ¤ŁņŚÉ ļ░░ņ╣śĒĢśņśĆļŗż. 4-╬╝m TMA ņĀłĒÄĖņØä ļ¦īļōżņ¢┤ ļ®┤ņŚŁņĪ░ņ¦üĒÖöĒĢÖņĀü Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż(Ventana Bench Mark XT Autostainer; Ventana Medical Systems, Tucson, AZ, USA).
ņØ╝ņ░© ĒĢŁņ▓┤ļĪ£ HER-2/neu (RTU; clone 4B5; Ventana), PD-L1(dilution 1:100; clone SP142; Ventana), CD3(dilution 1:200; LabVision, Fremont, CA, USA), CD8 (RTU; clone C8/144B; Dako, Glostrup, Denmark)ņØä ņé¼ņÜ®ĒĢśņśĆļŗż.
<American Society of Clinical Oncology(ASCO)/College of American Pathologists (CAP) guideline recommendations for human epidermal growth factor receptor 2 (HER2) testing> ļ░®ļ▓ĢņŚÉ ļö░ļØ╝ņä£ HER2 ņ£ĀņĀäņ×É ņ”ØĒÅŁņØä ĒÖĢņØĖĒĢśĻ│Ā c-erbB2/HER2 ļŗ©ļ░▒ ļ░£ĒśäņØä 0, +1, +2, +3 ņ£╝ļĪ£ ĻĄ¼ļČäĒĢśņśĆļŗż. HER2 ņ¢æņä▒ņØĆ c-erbB2 3+ ņØ┤Ļ▒░ļéś HER2 ņ£ĀņĀäņ×É ņ”ØĒÅŁņØ┤ ĒÖĢņØĖļÉ£ Ļ▓ĮņÜ░ ņ¢æņä▒ņ£╝ļĪ£ ĒīÉņĀĢĒĢśņśĆļŗż.
ņØ┤ņĀä ņŚ░ĻĄ¼ņØś ļ░®ļ▓ĢņØä ņØ┤ņÜ®ĒĢśņŚ¼ PD-L1 ļ░£ĒśäņØä ņóģņ¢æņäĖĒżņÖĆ ļ®┤ņŚŁņäĖĒżļĪ£ ļČäļ”¼ĒĢśņŚ¼ ĒÖĢņØĖĒĢśņśĆņ£╝ļéś ņØ┤ņĀä ņŚ░ĻĄ¼ņÖĆ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ PD-L1 ņ¢æņä▒ ņóģņ¢æņäĖĒżļŖö ļ¦żņÜ░ ĻĄŁĒĢ£ļÉśņ¢┤ ņ׳Ļ│Ā ņĀüņ£╝ļ®░ ļ®┤ņŚŁņäĖĒżĻ░Ć ņ╣©ņ£żļÉ£ ĻĖ░ņ¦łņŚÉņä£ Ļ┤Ćņ░░ļÉśļŖö ņ¢æņāüņØ┤ņŚłĻĖ░ ļĢīļ¼ĖņŚÉ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļ®┤ņŚŁņäĖĒżņØś PD-L1 ņ¢æņä▒ļźĀļ¦īņØä ņŚ░ĻĄ¼ ļīĆņāüņ£╝ļĪ£ ņé╝ņĢśļŗż[8]. ļśÉĒĢ£ ņØ┤ļź╝ ņ£äĒĢ┤ ņČöĻ░ĆņĀüņ£╝ļĪ£ CD3 ņŚ╝ņāēņØä ņČöĻ░ĆņĀüņ£╝ļĪ£ ņŗżņŗ£ĒĢśņśĆļŗż. PD-L1 ļ░£Ēśäņ£©ņØ┤ 5% ņØ┤ņāüņØĖ Ļ▓ĮņÜ░ ņ¢æņä▒ņ£╝ļĪ£ ĒīÉņĀĢĒĢśņśĆļŗż.
ņóģņ¢æņäĖĒżĻĄ░ņ¦æņŚÉ ņ╣©ņ£żĒĢśļŖö ņóģņ¢æņ╣©ņ£żļ”╝ĒöäĻĄ¼(tumor infiltrating lymphocyte, TILs)ņØś ņ¢æņØĆ 400x magnification high-power fields ĒĢśņŚÉņä£ ļīĆĒæ£ņĀüņØĖ ņĪ░ņ¦ü ļČĆļČä ļŗżņä»Ļ││ņØä ĒÖĢņØĖĒĢśņŚ¼ ĒÅēĻ░ĆĒĢśņśĆļŗż. CD3ņÖĆ CD8ņØä ļ░£ĒśäĒĢśļŖö ļ”╝ĒöäĻĄ¼ļź╝ ņØ╝ņØ╝ņØ┤ ņäĖņ¢┤ņä£ ĻĘĖ Ļ░»ņłśļź╝ ĒÅēĻĘĀĒĢśņśĆļŗż. ņóģņ¢æņ╣©ņ£żļ”╝ĒöäĻĄ¼ ļ╣äņżæņØś ņżæņĢÖĻ░ÆņØä ĻĖ░ņżĆņ£╝ļĪ£ ĒÖśņ×ÉĻĄ░ņØä low TIL abundanceņÖĆ high TIL abundance ĻĘĖļŻ╣ņ£╝ļĪ£ ļČäļźśĒĢśņśĆļŗż(CD3 13/HPF, CD8 5/HPF).
ļ│ĆņłśĻ░ä ņ░©ņØ┤ļź╝ ļČäņäØĒĢśĻĖ░ ņ£äĒĢ┤ Žć2, Fisher exact, linear-by-linear methodļź╝ ņé¼ņÜ®ĒĢśņśĆļŗż. ņ▓śņØī ņ¦äļŗ©ļÉ£ ļéĀļĪ£ļČĆĒä░ ņé¼ļ¦ØņØ╝ Ēś╣ņØĆ ļ¦łņ¦Ćļ¦ē ņČöņĀüĻ┤Ćņ░░ņØ╝Ļ╣īņ¦ĆņØś ĻĖ░Ļ░äņØä ņĀäņ▓┤ņāØņĪ┤ĻĖ░Ļ░ä(overall survival)ņ£╝ļĪ£ ņĖĪņĀĢĒĢśņśĆļŗż. ņāØņĪ┤ļźĀļČäņäØņØä ņ£äĒĢ┤ Kaplan-Meier methodļź╝ ņé¼ņÜ®ĒĢśņśĆĻ│Ā log-rank test ļ░®ļ▓ĢņØä ņĀüņÜ®ĒĢśņśĆļŗż. Two-sided P valuesĻ░Ć 0.05ļ»Ėļ¦īņØ╝ ļĢī ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśļŗżĻ│Ā ĒīÉņĀĢĒĢśņśĆļŗż. IBM SPSS 23 software for Windows (IBM Corp, Armonk, NY, USA)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ļČäņäØņØä ņŗ£Ē¢ēĒĢśņśĆļŗż.
ļé©ņä▒ņØś ļ╣äņ£©ņØ┤ ļåÆņĢśĻ│Ā(78%, 26/33) ņ¦äļŗ© ņŗ£ ņŚ░ļĀ╣ņØś ņżæņĢÖĻ░ÆņØĆ 58ņäĖņśĆļŗż(range, 40-90 years old). ĒØĪņŚ░Ļ│╝ ņØīņŻ╝ņŚÉņä£ ĒŖ╣ņØ┤ņé¼ĒĢŁņØĆ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż. 33Ļ░£ņØś ņé¼ļĪĆ ņżæ ņØ┤ĒĢśņäĀ ĻĖ░ņøÉņØ┤ 31 ņé¼ļĪĆļĪ£ Ļ░Ćņן ļåÆņĢśļŗż. ņ¦äļŗ© ļŗ╣ņŗ£ ņĀłļ░ś ņØ┤ņāüņØś ĒÖśņ×ÉņŚÉņä£ ņ¦äĒ¢ēļÉ£ ņĢö ļ│æĻĖ░ņØś ņåīĻ▓¼ņØä ļ│┤ņśĆļŗż(T stage 3-4:51%; N stage 1-2:51%; AJCC cancer stage III-IV: 81%)(Table 1). ņĀäņ▓┤ ĒÅēĻĘĀ ņāØņĪ┤ ĻĖ░Ļ░äņØĆ 75.6Ļ░£ņøö, ņĀäņ▓┤ ņāØņĪ┤ ņżæņĢÖĻ░ÆņØĆ 62Ļ░£ņøöņØ┤ņŚłĻ│Ā ņĀäņ▓┤ 5ļģä ņāØņĪ┤ņ£©ņØĆ 30.3%ņśĆļŗż.
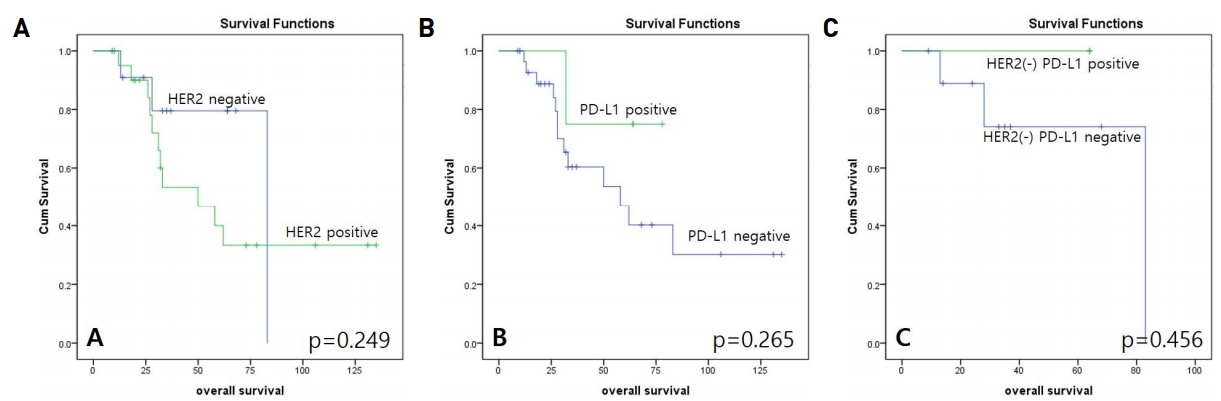
c-erbB2/HER2 ļŗ©ļ░▒ ļ░£ĒśäņØ┤ 2+ņØ┤ņāüņØĖ Ļ▓ĮņÜ░ļŖö 33Ļ░£ ņé¼ļĪĆ ņżæ 24Ļ░£ņØś ņé¼ļĪĆņŚÉņä£(72.7%) Ļ┤Ćņ░░ļÉśņŚłĻ│Ā HER2 ņ£ĀņĀäņ×É ņ”ØĒÅŁņØĆ 33 ņé¼ļĪĆ ņżæ 21Ļ░£ņØś ņé¼ļĪĆņŚÉņä£(63.6%) Ļ┤Ćņ░░ļÉśņŚłļŗż. HER2 ņ¢æņä▒ļźĀ(c-erbB2 3+ and/or HER2 gene amplification)ņØĆ ņĀäņ▓┤ņØś 63.6%(21/33)ņŚÉņä£ Ļ┤Ćņ░░ļÉśņŚłļŗż. ĻĘĖļ¤¼ļéś HER2 ņ¢æņä▒ņŚ¼ļČĆņÖĆ ĒÖśņ×ÉņØś ņāØņĪ┤ļźĀĻ│╝ņØś ņ£ĀņØśĒĢ£ ņŚ░Ļ┤Ćņä▒ņØĆ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż(p=0.249)(Fig. 1).
33Ļ░£ņØś ņé¼ļĪĆ ņżæ 4Ļ░£ņØś ņé¼ļĪĆņŚÉņä£ PD-L1 ļ░£ĒśäņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż. PD-L1 ļ░£ĒśäĻ│╝ Ļ░üĻ░üņØś ņ×äņāüļ│æļ”¼ņĀü ļ│ĆņłśĻ░äņŚÉ ņ£ĀņØśĒĢ£ ņŚ░Ļ┤Ćņä▒ņØĆ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż(Table 2).
PD-L1 ņ¢æņä▒ņØĖ ĒÖśņ×ÉņŚÉņä£ņØś ĒÅēĻĘĀ ņāØņĪ┤ĻĖ░Ļ░äņØĆ 66.5Ļ░£ņøöņØ┤ņŚłņ£╝ļ®░ ņØīņä▒ņØĖ ĒÖśņ×ÉĻĄ░ņŚÉņä£ļŖö 70Ļ░£ņøöņØ┤ņŚłņ£╝ļéś ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż(p=0.265). PD-L1 ņ¢æņä▒ņØĖ ĒÖśņ×ÉĻĄ░ņŚÉņä£ 5ļģä ņāØņĪ┤ņ£©ņØĆ 75%ļĪ£ ņØīņä▒ņØĖĻĄ░Ļ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ĒśäņĀĆĒ׳ ļåÆņØĆ Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆņ£╝ļ®░ ņĀäņ▓┤ 5ļģä ņāØņĪ┤ņ£© 30.3%ņÖĆ ļ╣äĻĄÉĒĢśņŚ¼ļÅä ĒśäņĀĆĒ׳ ļåÆņØĆ ņāØņĪ┤ņ£©ņØä ļ│┤ņśĆļŗż. HER2Ļ░Ć ņØīņä▒ņØĖ ĒÖśņ×ÉĻĄ░ļ¦īņØä ļö░ļĪ£ ļČäļ”¼ĒĢśņŚ¼ ņŗ£Ē¢ēĒĢ£ ļČäņäØņŚÉņä£ļŖö PD-L1 ņ¢æņä▒ņŚ¼ļČĆņŚÉ ļö░ļźĖ ņ£ĀņØśĒĢ£ ņāØņĪ┤ņ£© ņ░©ņØ┤ļŖö ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(p=0.456)(Fig. 1).
PD-L1 ļ░£ĒśäņŚ¼ļČĆņÖĆ CD3+ ņóģņ¢æņ╣©ņ£żļ”╝ĒöäĻĄ¼, CD8+ņóģņ¢æņ╣©ņ£żļ”╝ĒöäĻĄ¼ņØś ļ╣äņżæ ņé¼ņØ┤ņŚÉ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņŚ░Ļ┤Ćņä▒ņØĆ ļ░£Ļ▓¼ļÉśņ¦Ć ņĢŖņĢśļŗż(Table 2). HER2 ņ¢æņä▒ņŚ¼ļČĆņÖĆ CD3+ņóģņ¢æņ╣©ņ£żļ”╝ĒöäĻĄ¼ņØś ļ╣äņżæ(p= 0.157), CD8+ ņóģņ¢æņ╣©ņ£żļ”╝ĒöäĻĄ¼ņØś ļ╣äņżæ(p=0.741) Ļ░äņŚÉļÅä ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņŚ░Ļ┤Ćņä▒ņØĆ ļ░£Ļ▓¼ļÉśņ¦Ć ņĢŖņĢśļŗż. ļśÉĒĢ£ CD3+ņóģņ¢æņ╣©ņ£żļ”╝ĒöäĻĄ¼ņØś ļ╣äņżæĻ│╝ ņāØņĪ┤ļźĀ(p=0.568), CD8+ ņóģņ¢æņ╣©ņ£żļ”╝ĒöäĻĄ¼ņØś ļ╣äņżæĻ│╝ ņāØņĪ┤ļźĀ(p=0.568)Ļ│╝ņØś ņ£ĀņØśĒĢ£ ņŚ░Ļ┤Ćņä▒ņØĆ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż.
ņ╣©ņāśĻ┤ĆņĢöņŚÉņä£ HER2 ņ¢æņä▒ ņåīĻ▓¼ņØ┤ ļ╣łļ▓łĒĢśĻ▓ī Ļ┤Ćņ░░ļÉśĻ│Ā ĒĢŁ HER2 ĒĢŁņĢöļ®┤ņŚŁņ╣śļŻīĻ░Ć ņ╣©ņāśĻ┤ĆņĢöņØś ņ╣śļŻīļĪ£ ņ¢ĖĻĖēļÉ£ ļ░öĻ░Ć ņ׳ņ¦Ćļ¦ī HER2 ņØīņä▒ņØĖ ņ╣©ņāśĻ┤ĆņĢö ĒÖśņ×ÉĻĄ░ņŚÉ ļīĆĒĢ┤ņä£ ĒĢŁ HER2 ņ╣śļŻīļ▓ĢņØś ņĀüņÜ®ņŚÉļŖö ļ¬©ņł£ņØ┤ ņ׳Ļ│Ā ĻĘĖ ĒÜ©Ļ│╝ņŚÉļÅä ļģ╝ļ×ĆņØ┤ ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ ņĄ£ĻĘ╝ ļŗżņ¢æĒĢ£ ļ®┤ņŚŁ Ēæ£ņ¦Ćņ×ÉļōżņØ┤ ņ╣©ņāśĻ┤ĆņĢöņØś ņ╣śļŻīļĪ£ Ļ│ĀļĀżļÉśĻ│Ā ņ׳ļŗż[3,4]. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĒĢŁ HER2 ņ╣śļŻīļź╝ ļ░øņØĆ ĒÖśņ×Éļź╝ ņĀ£ņÖĖĒĢśĻ│Ā ņŗ£Ē¢ēņŚ░ĻĄ¼ļź╝ ņ¦äĒ¢ēĒĢśņśĆĻ│Ā HER2 ņ¢æņä▒ņ£©ņØĆ 63.6%ļĪ£ ļåÆĻ▓ī ļ│┤Ļ│ĀļÉśņŚłļŗż. ĻĘĖļ¤¼ļéś HER2 ņ¢æņä▒ņŚ¼ļČĆņÖĆ ņāØņĪ┤ļźĀĻ│╝ņØś ņŚ░Ļ┤Ćņä▒ņØĆ ļ░£Ļ▓¼ļÉśņ¦Ć ņĢŖņĢśļŗż.
ņĄ£ĻĘ╝ ņ░©ņäĖļīĆ ļ®┤ņŚŁĒæ£ņ¦Ćņ×ÉļĪ£ ņŻ╝ļ¬®ļ░øĻ│Ā ņ׳ļŖö PD-L1ņØ┤ ņ╣©ņāśĻ┤ĆņĢö ĒÖśņ×ÉņØś ņāØņĪ┤ļźĀņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ļČäņäØĒĢ£ Ļ▓░Ļ│╝, ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ Ļ▓░Ļ│╝ļŖö ļ░£Ļ▓¼ļÉśņ¦Ć ņĢŖņĢśļŗż. ĻĘĖļ¤¼ļéś ļ®┤ņŚŁņäĖĒżņØś PD-L1 ļ░£ĒśäņØ┤ ļåÆņØĆĻĄ░ņŚÉņä£ 5ļģä ņāØņĪ┤ļźĀņØĆ 75%ļĪ£, ļ░£ĒśäņØ┤ ļé«ņØĆ ĻĄ░ņØś 24%ņŚÉ ļ╣äĒĢ┤ ņ¢æĒśĖĒĢ£ Ļ▓ĮĒ¢źņØä ļ│┤ņśĆļŗż. ņØ┤ļŖö ļæÉĻ▓ĮļČĆņĢö ĒÖśņ×É 402ļ¬ģņØä ļīĆņāüņ£╝ļĪ£ ļÅÖņØ╝ ĻĖ░Ļ┤ĆņŚÉņä£ ņŗ£Ē¢ēĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ ņóģņ¢æņ╣©ņ£żļ”╝ĒöäĻĄ¼ņØś PD-L1 ļ░£ĒśäņØ┤ ļåÆņØĆ ĒÖśņ×ÉĻĘĖļŻ╣ņØ┤ ļåÆņØĆ ņāØņĪ┤ļźĀņØä ļ│┤ņśĆļŗżļŖö Ļ▓░Ļ│╝ņÖĆ ļČĆĒĢ®ĒĢśļŖö ņåīĻ▓¼ņØ┤ļŗż[9].
18ļ¬ģņØś ņ╣©ņāśĻ┤ĆņĢö ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ Sato ļō▒ņØś ņĄ£ĻĘ╝ ņŚ░ĻĄ¼ņŚÉņä£ļÅä ņ╣©ņāśĻ┤ĆņĢöņŚÉņä£ PD-L1ņØ┤ ņāØņĪ┤ņ£©ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ļČäņäØĒĢśņśĆļŖöļŹ░ ņóģņ¢æņäĖĒżņŚÉņä£ PD-L1ņØś ļ░£ĒśäļźĀņØ┤ ļåÆņØĆ ĻĘĖļŻ╣ņŚÉņä£ ņāØņĪ┤ņ£©ņØ┤ ļé«Ļ▓ī ļéśĒāĆļé¼ņØīņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż[10].
ļśÉĒĢ£ Mukaigawa ļō▒ņØĆ ņ┤Ø 219ļ¬ģņØś ņ╣©ņāśņĢö ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ PD-L1ņØś ļ░£ĒśäņØ┤ ņāØņĪ┤ņ£©ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ņĪ░ņé¼Ē¢łļŖöļŹ░ 219ļ¬ģņØś ĒÖśņ×É ņżæ 31ļ¬ģņØ┤ ņ╣©ņāśĻ┤ĆņĢö ĒÖśņ×ÉņśĆĻ│Ā ņØ┤ņżæ ņóģņ¢æņäĖĒżņŚÉņä£ PD-L1 ņ¢æņä▒ņØä ļ│┤ņØĖ ĒÖśņ×ÉĻ░Ć 15ļ¬ģ, ļ®┤ņŚŁņäĖĒżņŚÉņä£ PD-L1 ņ¢æņä▒ņØä ļ│┤ņØĖ ĒÖśņ×ÉĻ░Ć 9ļ¬ģņØ┤ņŚłļŗż. ņØ┤ ļģ╝ļ¼ĖņŚÉņä£ ņ╣©ņāśĻ┤ĆņĢö ĒÖśņ×Éļ¦īņØä ļīĆņāüņ£╝ļĪ£ ļö░ļĪ£ PD-L1 ņ¢æņä▒ ņóģņ¢æņäĖĒż ļ╣äņżæ, PD-L1 ņ¢æņä▒ ļ®┤ņŚŁņäĖĒż ļ╣äņżæĻ│╝ ņāØņĪ┤ņ£©ņØś Ļ┤ĆĻ│äļź╝ ņĀ£ņŗ£ĒĢśņ¦ĆļŖö ņĢŖņĢśņ¦Ćļ¦ī ņ╣©ņāśņĢö ņĀäņ▓┤ ĒÖśņ×ÉņŚÉņä£ ņóģņ¢æņäĖĒżļéś ļ®┤ņŚŁņäĖĒżņØś PD-L1ņØś ļ░£ĒśäņØ┤ ļåÆņØĆ Ļ▓ĮņÜ░ ņāØņĪ┤ļźĀņØ┤ ļé«ņØĆ Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņŚłļŗż[6].
11ļ¬ģņØś ņ╣©ņāśĻ┤ĆņĢö ĒÖśņ×Éļź╝ ĒżĒĢ©ĒĢ┤ņä£ ņ┤Ø 70ļ¬ģņØś ņ╣©ņāśņĢö ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ PD-L1ņØś ļ░£ĒśäņØ┤ ņāØņĪ┤ņ£©ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ļČäņäØĒĢ£ Chang ļō▒ņØś ņŚ░ĻĄ¼ņŚÉņä£ļŖö PD-L1 ņØīņä▒ņØĖ ĻĄ░ņŚÉņä£ ņāØņĪ┤ņ£©ņØ┤ ļåÆņĢśņ£╝ļéś ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņŚ░Ļ┤Ćņä▒ņØĆ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśĻ│Ā Change ļō▒ņØś ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņóģņ¢æņäĖĒżņÖĆ ļ®┤ņŚŁņäĖĒżņŚÉņä£ņØś ļ░£ĒśäņØä ļö░ļĪ£ ļČäļźśĒĢśņ¦Ć ņĢŖĻ│Ā ņŚ░ĻĄ¼ļź╝ ņ¦äĒ¢ēĒĢśņśĆļŗż[11].
ņ╣©ņāśĻ┤ĆņĢöņØ┤ ĒżĒĢ©ļÉśņ¦ĆļŖö ņĢŖņĢśņ¦Ćļ¦ī 47ļ¬ģņØś ņ╣©ņāśņĢö ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ Harada ļō▒ņØś ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņóģņ¢æņäĖĒżļéś ļ®┤ņŚŁņäĖĒż ļ¬©ļæÉņŚÉņä£ PD-L1ņØä ļåÆĻ▓ī ļ░£ĒśäĒĢ£ ĻĄ░ņØś ņāØņĪ┤ņ£©ņØ┤ ļé«Ļ▓ī ļ│┤Ļ│ĀļÉśņŚłļŗż[12].
Ļ░üĻ░üņØś ņŚ░ĻĄ¼ļ¦łļŗż PD-L1ņØś ļ░£Ēśäņ£©Ļ│╝ ņāØņĪ┤ņ£©Ļ│╝ņØś ņŚ░Ļ┤Ćņä▒ ļČäņäØņŚÉ ņ░©ņØ┤Ļ░Ć ņ׳ņŚłļŖöļŹ░ ņØ┤ņŚÉ ļīĆĒĢ┤ņä£ PD-L1 ņ¢æņä▒ ņŚ¼ļČĆļź╝ ĒīÉņĀĢĒĢśļŖö ĻĖ░ņżĆĻ│╝ ņóģņ¢æņäĖĒż, ļ®┤ņŚŁņäĖĒżļź╝ ļČäļźśĒĢ┤ņä£ PD-L1 ņ¢æņä▒ ņŚ¼ļČĆļź╝ ĒīÉņĀĢĒĢśļŖö ĻĖ░ņżĆņØ┤ ņŚ░ĻĄ¼ļ¦łļŗż ņ░©ņØ┤Ļ░Ć ņ׳Ļ│Ā ņØ╝Ļ┤ĆļÉ£ ĻĖ░ņżĆņØ┤ ļČĆņ×¼ļÉśņ¢┤ ņ׳ļŗżļŖö ņĀÉņØä ņØĖņ¦ĆĒĢśĻ│Ā ņ׳ņ¢┤ņĢ╝ ĒĢ£ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö Kim ļō▒ņØś ņŚ░ĻĄ¼ņÖĆ Ļ░ÖņØ┤ 5% ņØ┤ņāüņØś PD-L1 ļ░£ĒśäņØä ņ¢æņä▒ņØĖ ĻĄ░ņ£╝ļĪ£ ņ▒äĒāØĒĢśņśĆļŗż[9]. ņ╣©ņāśĻ┤ĆņĢö ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ Sato ļō▒ņØś ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņóģņ¢æņäĖĒżņŚÉņä£ļŖö 10% ņØ┤ņāüņØä high, 1%-9%ļź╝ low, 0%ļź╝ nullņØś ņäĖ ĻĘĖļŻ╣ņ£╝ļĪ£ ļéśļłäļŖö ĻĖ░ņżĆņØä ņé¼ņÜ®ĒĢśņśĆĻ│Ā ļ®┤ņŚŁņäĖĒżņŚÉņä£ļŖö 10% ņØ┤ņāüņØä IC3, 10% ļ»Ėļ¦ī 5% ņØ┤ņāüņØä IC2, 1%ņØ┤ņāü 5%ļ»Ėļ¦īņØä IC1, 1%ļ»Ėļ¦īņØä IC0ņ£╝ļĪ£ ĒĢśņŚ¼ 4Ļ░£ņØś ĻĄ░ņ£╝ļĪ£ ļČäļźśĒĢśņśĆļŗż[10]. Sato ļō▒ņØś ņŚ░ĻĄ¼ņŚÉņä£ļŖö(1:200 dilution; clone E1L3N; Cell Signaling Technology, Denvers, MA) ņóģņ¢æņäĖĒżņŚÉņä£ 1% ņØ┤ņāüņØś PD-L1 ļ░£Ēśäņ£©ņØ┤ 18Ļ░£ņØś ņé¼ļĪĆ ņżæ 9Ļ░£ ņé¼ļĪĆļĪ£ 50%ņśĆĻ│Ā ļ®┤ņŚŁ ņäĖĒżņŚÉņä£ 5% ņØ┤ņāüņØś ļ░£Ēśäņ£©ņØĆ 18Ļ░£ņØś ņé¼ļĪĆ ņżæ 10 ņé¼ļĪĆļĪ£ 56%ļĪ£ ļåÆĻ▓ī ļ│┤Ļ│ĀļÉśņŚłņ£╝ļéś ļÅÖņØ╝ĒĢśĻ▓ī 5%ļź╝ ĻĖ░ņżĆņ£╝ļĪ£ ņäżņĀĢĒĢ£ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£(dilution 1:100; clone SP142; Ventana) ņ╣©ņāśĻ┤ĆņĢöņØś ļ®┤ņŚŁņäĖĒż PD-L1 ņ¢æņä▒ļźĀņØĆ 12%ņŚÉ ļČłĻ│╝Ē¢łļŗż. ņ╣©ņāśĻ┤ĆņĢö ĒÖśņ×Éļ¦īņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ Hederlein ļō▒ņØś ņŚ░ĻĄ¼ņŚÉņä£ļŖö 5% ņØ┤ņāüņØä ņ¢æņä▒ņØś ĻĖ░ņżĆņ£╝ļĪ£ ņĀüņÜ®ĒĢśņśĆĻ│Ā 50ļ¬ģņØś ņ╣©ņāśĻ┤ĆņĢö ĒÖśņ×Éņżæ 22%ņŚÉņä£ PD-L1 ņ¢æņä▒ņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņŚłļŗż. ĻĘĖļ¤¼ļéś ņØ┤ ņŚ░ĻĄ¼ņŚÉņä£ļÅä ņóģņ¢æņäĖĒżņÖĆ ļ®┤ņŚŁņäĖĒżļź╝ ļČäļźśĒĢśņŚ¼ ņ¢æņä▒ļźĀņØä ņĀ£ņŗ£ĒĢśņ¦ĆļŖö ņĢŖņĢśļŗż(dilution 1:200; clone 28-8; Abcam, Cambridge, UK) [13].
Mukaigawa ļō▒ņØś ņŚ░ĻĄ¼ņŚÉņä£ļŖö PD-L1 ņ¢æņä▒ņØä ļ│┤ņØ┤ļŖö ņäĖĒżĻ░Ć 1% ņØ┤ņāüņØĖ Ļ▓ĮņÜ░ ņ¢æņä▒ņ£╝ļĪ£ ņ▒äĒāØĒĢśņśĆĻ│Ā Chang ļō▒ņØś ņŚ░ĻĄ¼ņŚÉņä£ļŖö H-score ļ░®ļ▓ĢņØä ņĀüņÜ®ĒĢśņŚ¼ ņ¢æņä▒ ņŚ¼ļČĆļź╝ ĒīÉļŗ©ĒĢśņśĆļŗż[6,11]. ņ╣©ņāśņĢöņØä ļīĆņāüņ£╝ļĪ£ ņŚ░ĻĄ¼ĒĢ£ Mukaigawa ļō▒ņØś ņŚ░ĻĄ¼ņÖĆ Chang ļō▒ņØś Ļ▓░Ļ│╝ļź╝ ļ╣äĻĄÉĒĢ┤ ļ│┤ļ®┤ Chang ļō▒ņØś ņŚ░ĻĄ¼ņŚÉņä£(dilution 1:100; rabbit polyclonal; Abcam, Cambridge, UK) PD-L1 ņ¢æņä▒ņ£©ņØä ņĀ£ņŗ£ĒĢ£ ņäĀņ¢æļéŁņä▒ņĢöņóģ(adenoid cystic carcinoma), ņ╣©ņāśĻ┤ĆņĢö, ņĀÉņĢĪĒæ£Ēö╝ņ¢æņĢöņóģ(mucoepidermoid carcinoma) ĒÖśņ×ÉļŖö ņ┤Ø 53ļ¬ģņØ┤ņŚłĻ│Ā ņØ┤ņżæ 16ļ¬ģņŚÉņä£ PD-L1 ņ¢æņä▒ņØ┤ Ļ┤ĆņĖĪļÉśņŚłļŗż(30%). Mukaigawa ļō▒ņØś ņŚ░ĻĄ¼ņŚÉņä£ļŖö(dilution 1:400; clone E1L3N; Cell Signaling Technology, Danvers, MA) ņóģņ¢æņäĖĒżņŚÉņä£ļŖö 22.8%, ļ®┤ņŚŁņäĖĒżņŚÉņä£ļŖö 12.8%ņŚÉņä£ ņ¢æņä▒ ņåīĻ▓¼ņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż. 402ļ¬ģņØś ļæÉĻ▓ĮļČĆ Ļ│ĀĒśĢņĢö ņĀäņ▓┤ļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ Kim ļō▒ņØś ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņóģņ¢æņäĖĒżņŚÉņä£ļŖö 18.2%, ļ®┤ņŚŁņäĖĒżņŚÉņä£ļŖö 27%ņØś ņ¢æņä▒ļźĀņØ┤ Ļ┤ĆņĖĪļÉśņŚłļŗż(dilution 1:100; clone SP142; Ventana) [9].
PD-L1 ļ░£ĒśäņØ┤ ņ×äņāüņĀüņØĖ Ļ▓░Ļ│╝ņŚÉ ņ¢┤ļ¢ż ņśüĒ¢źņØä ļ»Ėņ╣śļŖöņ¦ĆņŚÉ ļīĆĒĢ┤ņä£ļŖö ņŚ░ĻĄ¼ļ¦łļŗż Ļ▓░Ļ│╝ņŚÉ ņ░©ņØ┤Ļ░Ć ņ׳Ļ│Ā ņĢäņ¦üĻ╣īņ¦Ć ļģ╝ļ×ĆņØ┤ ņ׳ļŗż. ņĢ×ņä£ ņé┤ĒÄ┤ļ│Ė Mukaigawa ļō▒ņØś ņŚ░ĻĄ¼ņÖĆ Harada ļō▒ņØś ņŚ░ĻĄ¼ņŚÉņä£ļ¦ī ļ│┤ļŹöļØ╝ļÅä ļ®┤ņŚŁņäĖĒżņŚÉņä£ PD-L1ņØä ļ░£ĒśäĒĢ£ ĻĄ░ņŚÉņä£ ņāØņĪ┤ņ£©ņØ┤ ļŹö ļé«Ļ▓ī ļ│┤Ļ│ĀļÉśņ¢┤ PD-L1ņØś ļ░£ĒśäņØ┤ ņ╣©ņāśĻ┤ĆņĢö ĒÖśņ×ÉņØś ņāØņĪ┤ņ£©ņŚÉ ļ»Ėņ╣śļŖö ņØ╝Ļ┤ĆļÉ£ Ļ▓░ļĪĀņØä ļÅäņČ£ĒĢśĻĖ░ņŚÉļŖö ņ¢┤ļĀżņøĆņØ┤ ņ׳ļŗż[6,12]. ņØ┤ņÖĆ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ HPV ņ¢æņä▒ņØĖ ļæÉĻ▓ĮļČĆ ĒÄĖĒÅēņäĖĒżņĢöņóģ ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļŖö PD-1ņØä ļ░£ĒśäĒĢśļŖö ņóģņ¢æņ╣©ņ£żļ”╝ĒöäĻĄ¼ņØś ļ╣äņżæņØ┤ ļåÆņØĆĻĄ░ņŚÉņä£ ņāØņĪ┤ņ£©ņØ┤ ļåÆĻ▓ī ļéśĒāĆļéśĻĖ░ļÅä Ē¢łļŗż[14].
ļŗżļźĖ ņóģļźśņØś ņĢöņŚÉņä£ ņŗ£Ē¢ēĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņØ┤ņÖĆļŖö ņāüļ░śļÉ£ Ļ▓░Ļ│╝ļōżņØä ļ░£Ēæ£ĒĢ£ ņŚ░ĻĄ¼ļōżļÅä ņ׳ļŖöļŹ░, ĻĄÉļ¬©ņäĖĒżņóģ(glioblastoma)Ļ│╝ Ļ┤Ćņāüņ£Āļ░®ņĢö(luminal breast cancer)ņŚÉņä£ ņóģņ¢æņäĖĒżņØś PD-L1 ļ░£ĒśäņØ┤ ļåÆņØäņłśļĪØ ņāØņĪ┤ņ£©ņØ┤ ļé«Ļ▓ī ļ│┤Ļ│ĀļÉśņŚłĻ│Ā[15,16], ņŗĀņןņĢö(renal cell carcinoma) ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ Thompson ļō▒ņØś ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļ®┤ņŚŁņäĖĒżņŚÉņä£ PD-1 ļ░£ĒśäņØĆ ņĢłņóŗņØĆ ņśłĒøäņÖĆ ņŚ░Ļ┤ĆņØ┤ ņ׳ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢ£ ļ░ö ņ׳ņ£╝ļ®░[17], ļæÉĻ▓ĮļČĆņĢö ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ Kim HR ļō▒ņØś ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļ®┤ņŚŁņäĖĒżņØś PD-L1 ļ░£ĒśäņØ┤ ņóŗņØĆ ņśłĒøäņÖĆ ņŚ░Ļ┤ĆņØ┤ ņ׳ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśĻĖ░ļÅä Ē¢łļŗż[9].
ņØ┤ņ▓śļ¤╝ PD-1, PD-L1ņØ┤ ņśłĒøäņŚÉ ņ¢┤ļ¢ż ņśüĒ¢źņØä ļ»Ėņ╣śļŖöņ¦ĆņŚÉ ļīĆĒĢ┤ņä£ļŖö ļģ╝ļ×ĆņØ┤ ņ׳ļŗż. ĻĘĖļ¤¼ļéś Ēśäņ×¼Ļ╣īņ¦Ć ņ¦äĒ¢ēļÉśņ¢┤ ņś© Ļ┤ĆļĀ©ļÉ£ ņŚ░ĻĄ¼ļōżņØś ļīĆļČĆļČäņØ┤ PD-L1ņØś ļ░£ĒśäņØä ņóģņ¢æņäĖĒżņÖĆ ņóģņ¢æņ╣©ņ£żļ®┤ņŚŁņäĖĒżļź╝ ņäĖņŗ¼ĒĢśĻ▓ī ļČäļźśĒĢ┤ņä£ ņ¦äĒ¢ēĒĢśņ¦Ć ņĢŖņĢśļŗżļŖö ņĀÉņØä ņŻ╝ļ¬®ĒĢĀ ĒĢäņÜöĻ░Ć ņ׳ļŗż. ņŗżņĀ£ļĪ£ ņŚ¼ļ¤¼ ņŚ░ĻĄ¼ņŚÉņä£ ņóģņ¢æņäĖĒżņÖĆ ļ®┤ņŚŁņäĖĒżņŚÉņä£ņØś PD-L1ņØ┤ ļŗżļźĖ Ļ▓ĮļĪ£ļź╝ ĒåĄĒĢ┤ņä£ ļ░£ĒśäņØ┤ ļÉ£ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśĻ│Ā ņ׳ņ£╝ļ®░, KimņØś ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņóģņ¢æņäĖĒżņÖĆ ļ®┤ņŚŁņäĖĒżņŚÉņä£ ļÅÖņŗ£ņŚÉ PD-L1ņØ┤ ļ░£ĒśäļÉśļŖö Ļ▓ĮņÜ░Ļ░Ć 1%ļ»Ėļ¦īņØ┤ļØ╝ļŖö Ļ▓░Ļ│╝ļź╝ ļ│┤Ļ│ĀĒĢśĻĖ░ļÅä ĒĢśņśĆļŗż[10]. ņØ┤ļ¤¼ĒĢ£ ņĀÉņ£╝ļĪ£ ļ»ĖļŻ©ņ¢┤ ļ│╝ ļĢī ņóģņ¢æņäĖĒżņÖĆ ļ®┤ņŚŁņäĖĒżņŚÉņä£ PD-L1 ļ░£ĒśäņØä ņäĖņŗ¼ĒĢśĻ▓ī ļČäļźśĒĢśņŚ¼ ņāØņĪ┤ļźĀĻ│╝ņØś ņŚ░Ļ┤Ćņä▒ņØä ĒÖĢņØĖĒĢ£ļŗżļ®┤ ņČöĒøä ņØ╝Ļ┤ĆļÉ£ Ļ▓░Ļ│╝Ļ░Ć ļÅäņČ£ļÉĀ Ļ░ĆļŖźņä▒ņØ┤ ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż.
ņ╣©ņāśĻ┤ĆņĢöņŚÉņä£ PD-L1ņØś ļ░£Ēśäņ£©ņØ┤ ļŗżļźĖ ņ¦łĒÖśņŚÉ ļ╣äĒĢ┤ ļé«ņØĆ ņĀÉļÅä ņŻ╝ļ¬®ĒĢĀ ĒĢäņÜöĻ░Ć ņ׳ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ PD-L1 ņ¢æņä▒ĒīÉņĀĢ ĻĖ░ņżĆņØä 1%ļĪ£ ļé«ņČ░ ņ¢æņä▒ļźĀņØä ļåÆņØ┤ļ®┤ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ Ļ▓░Ļ│╝Ļ░Ć ļÅäņČ£ļÉĀ ņłśļÅä ņ׳ņ£╝ļéś ņ¢ĖĻĖēĒĢ£ ļ░öņÖĆ Ļ░ÖņØ┤ ĒĢŁņ▓┤ ņĀ£ņĪ░ņé¼Ļ░Ć ņŚ░ĻĄ¼ļ¦łļŗż ļŗżļź┤Ļ│Ā ĒīÉņĀĢņØś ĻĖ░ņżĆļÅä ļŗżļź┤ĻĖ░ ļĢīļ¼ĖņŚÉ PD-L1ņØ┤ ņ╣©ņāśĻ┤ĆņĢöņØś Ļ▓ĮĻ│╝ņŚÉ ļ»Ėņ╣śļŖö ņØ╝Ļ┤ĆļÉ£ ņśüĒ¢źņØä ļ╣äĻĄÉĒĢśĻĖ░ņŚÉļŖö ņ¢┤ļĀżņøĆņØ┤ ņ׳ļŗż. ĻĘĖļĀćĻĖ░ ļĢīļ¼ĖņŚÉ ļÅÖņØ╝ĒĢ£ ĒĢŁņ▓┤ņÖĆ ļ░®ļ▓ĢņØä ņé¼ņÜ®ĒĢ£ ļÅÖņØ╝ ĻĖ░Ļ┤ĆņØś Ļ▓░Ļ│╝ņÖĆ ļ╣äĻĄÉĒĢśĻĖ░ ņ£äĒĢ┤ ļ│Ė ņŚ░ĻĄ¼ļŖö 5%ņØś ĻĖ░ņżĆņØä ņ¢æņä▒ ĒīÉņĀĢ ĻĖ░ņżĆņ£╝ļĪ£ ņé¼ņÜ®ĒĢśņśĆĻ│Ā ņØ┤ļź╝ ĒåĄĒĢ┤ ļæÉĻ▓ĮļČĆņĢö ņĀäņ▓┤ ļīĆņāüĻĄ░ņŚÉ ļ╣äĒĢ┤ņä£ ņ╣©ņāśĻ┤ĆņĢö ĒÖśņ×ÉņŚÉņä£ PD-L1ņØś ņ¢æņä▒ļźĀņØ┤ ļé«Ļ▓ī ļ│┤Ļ│ĀļÉ£ļŗżļŖö ņĀÉņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ļ│Ė ņŚ░ĻĄ¼ņÖĆ ļÅÖņØ╝ĻĖ░Ļ┤ĆņŚÉņä£ ļæÉĻ▓ĮļČĆņĢö ĒÖśņ×É ņĀäņ▓┤ļź╝ ļīĆņāüņ£╝ļĪ£ ņŗ£Ē¢ēĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ ļ®┤ņŚŁņäĖĒżņØś PD-L1 ņ¢æņä▒ļźĀņØĆ 27%ņśĆņ£╝ļéś Ļ░ÖņØĆ ļ░®ļ▓ĢņØä ņé¼ņÜ®ĒĢ£ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ņØś ņ¢æņä▒ļźĀņØĆ 12%ņŚÉ ļČłĻ│╝Ē¢łļŗż[9]. ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ ļÅÖņØ╝ĒĢ£ ļ░®ļ▓ĢņØä ņé¼ņÜ®ĒĢ£ ņŚ░ĻĄ¼ Ļ░äņŚÉ ļ╣äĻĄÉļź╝ ĒåĄĒĢ┤ņä£ ņ╣©ņāśĻ┤ĆņĢöņŚÉņä£ PD-L1ņØś ņ¢æņä▒ļźĀņØä ļŗżļźĖ ņ¦łĒÖśņØś ņ¢æņä▒ļźĀĻ│╝ ļ╣äĻĄÉĒĢ┤ ļ│╝ ņłś ņ׳ļŗż. Hederlein ļō▒ņØś ņŚ░ĻĄ¼ņÖĆ Ļ░ÖņØĆ ĻĖ░ņżĆĻ│╝ ļ░®ļ▓ĢņØä ņé¼ņÜ®ĒĢśņŚ¼ ņĪ░ņ¦üĻĄ¼, ņłśņ¦ĆņāüņäĖĒż ņ¦łĒÖśņŚÉņä£ PD-L1ņØś ļ░£Ēśäņ£©ņØä ņĪ░ņé¼ĒĢ£ Xu ļō▒ņØś ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņé¼ļź┤ņĮöņØ┤ļÅäņ”Ø(sarcoidosis) 7 ņé¼ļĪĆ ņżæ 7 ņé¼ļĪĆ ļ¬©ļæÉĻ░Ć(100%) ņ¢æņä▒ņØ┤ņŚłĻ│Ā, Kikuchi-Fujimoto ņ¦łĒÖśļÅä 6 ņé¼ļĪĆ ļ¬©ļæÉņŚÉņä£(100%) ņ¢æņä▒, Rosai-Dorfman ņ¦łĒÖś 11 ņé¼ļĪĆ ņżæ 2 ņé¼ļĪĆ(18%) ņŚÉņä£ PD-L1 ņ¢æņä▒ ņåīĻ▓¼ņØä ļ│┤ņśĆļŗż. ņØ┤ņŚÉ ļ░śĒĢ┤ Hederlein ļō▒ņØś ņŚ░ĻĄ¼ņŚÉņä£ ņ╣©ņāśĻ┤ĆņĢöņØś PD-L1 ņ¢æņä▒ļźĀņØĆ 22%ļĪ£ ļÅÖņØ╝ĒĢ£ ļ░®ļ▓ĢņØä ņé¼ņÜ®ĒĢ£ ļŗżļźĖ ņŚ░ĻĄ¼ņØś Ļ▓░Ļ│╝ņŚÉņä£ļ│┤ļŗż ļé«ņØĆ ņ¢æņä▒ļźĀņØä ļ│┤ņśĆļŗż[13,18]. Mukaigawa ļō▒ņØś ņŚ░ĻĄ¼ņÖĆ Ļ░ÖņØĆ ĻĖ░ņżĆĻ│╝ ļ░®ļ▓ĢņØä ņé¼ņÜ®ĒĢśņŚ¼ nonclear-cell renal cell carcinomaņŚÉņä£ PD-L1ņØś ļ░£Ēśäņ£©ņØä ņŚ░ĻĄ¼ĒĢ£ Choueiri ļō▒ņØś ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņóģņ¢æņäĖĒżņØś PD-L1 ņ¢æņä▒ļźĀņØĆ 10.9%, ļ®┤ņŚŁņäĖĒżņØś PD-L1 ņ¢æņä▒ņ£©ņØĆ 56.4%ļĪ£ ļ│┤Ļ│ĀļÉśņŚłļŗż. ņØ┤ņŚÉ ļ╣äĒĢ┤ Mukaigawa ļō▒ņØś ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņ╣©ņāśĻ┤ĆņĢö ņóģņ¢æņäĖĒżņŚÉņä£ņØś ņ¢æņä▒ļźĀņØĆ 48%, ļ®┤ņŚŁņäĖĒżņŚÉņä£ņØś ņ¢æņä▒ļźĀņØĆ 29%ļĪ£ ņóģņ¢æņäĖĒżņŚÉņä£ļŖö ĻĘĖ ļ░£Ēśäņ£©ņØ┤ ļåÆĻ▓ī ļ│┤Ļ│ĀļÉśņŚłņ£╝ļéś ļ®┤ņŚŁņäĖĒżņŚÉņä£ņØś ņ¢æņä▒ļźĀņØĆ ĒśäņĀĆĒ׳ ļé«Ļ▓ī ļ│┤Ļ│ĀļÉśņŚłļŗż[6,19]. Sato ļō▒ņØś ņŚ░ĻĄ¼ņÖĆ Ļ░ÖņØĆ ļ░®ļ▓ĢņØä ņé¼ņÜ®ĒĢśņŚ¼ ļ╣äņåīņäĖĒżĒÅÉņĢö(non small cell lumg cancer)ņŚÉņä£ PD-L1ņØś ļ░£ĒśäņŚÉ ļīĆĒĢ┤ ņĪ░ņé¼ĒĢ£ Garon ļō▒ņØś ņŚ░ĻĄ¼ņŚÉņä£ ņóģņ¢æņäĖĒżņŚÉņä£ PD-L1 ņ¢æņä▒ļźĀ(high)ņØĆ 36.6%ļĪ£ ļ│┤Ļ│ĀļÉśņŚłņ£╝ļéś Sato ļō▒ņØś ņŚ░ĻĄ¼ņŚÉņä£ ņóģņ¢æņäĖĒżņØś PD-L1 ņ¢æņä▒ļźĀ(high)ņØĆ 22%ļĪ£ ļ│┤Ļ│ĀļÉśņŚłļŗż. ļæÉ ņŚ░ĻĄ¼ņŚÉņä£ ĻĘĖ ļ░®ļ▓ĢņØĆ ļÅÖņØ╝ĒĢśņśĆņ£╝ļéś high expressionņØś ĻĖ░ņżĆņØä ļŗżļź┤Ļ▓ī ņäżņĀĢĒĢśņśĆļŖöļŹ░ Garon ļō▒ņØś ņŚ░ĻĄ¼ņŚÉņä£ļŖö 50%ņØ┤ņāüņØä, Sato ļō▒ņØś ņŚ░ĻĄ¼ņŚÉņä£ļŖö 10%ņØ┤ņāüņØś ļ░£ĒśäņØä high expressionņ£╝ļĪ£ ņäżņĀĢĒĢśņśĆļŗż. ņØ┤ņŚÉ ļīĆĒĢ┤ņä£ Sato ļō▒ņØĆ 50%ņØ┤ņāüņØś ļ░£ĒśäņØä ļ│┤ņØ┤ļŖö Ļ▓ĮņÜ░Ļ░Ć ĒĢśļéśļÅä ņŚåņŚłĻĖ░ ļĢīļ¼ĖņŚÉ 10% ņØ┤ņāüņØä highļĪ£ ņäżņĀĢĒĢśņśĆļŗżĻ│Ā ņ¢ĖĻĖēĒĢśņśĆļŗż[10,20].
ņĢīļĀżņ¦ä ļ░öņÖĆ Ļ░ÖņØ┤ ņ╣©ņāśĻ┤ĆņĢöņØĆ ļ¦żņÜ░ ļō£ļ¼Ė ņ¦łĒÖśņØ┤ĻĖ░ ļĢīļ¼ĖņŚÉ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļÅä ņČ®ļČäĒĢ£ ļīĆņāüņ×Éļź╝ ĒÖĢļ│┤ĒĢśĻĖ░ ņ¢┤ļĀżņøĀĻ│Ā ļśÉĒĢ£ PD-L1ņØś ļ░£Ēśäņ£©ņØ┤ ļé«ņĢä ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ Ļ▓░Ļ│╝ļź╝ ļÅäņČ£ĒĢ┤ ļé┤ĻĖ░ņŚÉļŖö ņ¢┤ļĀżņøĆņØ┤ ņ׳ņŚłļŗż. ĻĘĖļ¤¼ļéś ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ PD-L1 ņ¢æņä▒ ņóģņ¢æņ╣©ņ£żļ”╝ĒöäĻĄ¼ņØś ļ╣äņżæņØ┤ ļåÆņØĆ ĒÖśņ×ÉĻĄ░ņŚÉņä£ 5ļģä ņāØņĪ┤ļźĀņØ┤ ĒśäņĀĆĒ׳ ļåÆĻ▓ī Ļ┤Ćņ░░ļÉ£ ņĀÉņ£╝ļĪ£ ļ»ĖļŻ©ņ¢┤ ņ╣©ņāśĻ┤ĆņĢö ĒÖśņ×ÉņŚÉņä£ PD-1/PD-L1 Ļ▓ĮļĪ£ļź╝ ņØ┤ņÜ®ĒĢ£ ņ╣śļŻīļ░®ļ▓ĢņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļŖö ņČ®ļČäĒĢ£ Ļ░Ćņ╣śĻ░Ć ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ĻĘĖļ¤¼ļéś ņĢäņ¦üĻ╣īņ¦Ć PD-1/PD-L1ņØ┤ ņ×äņāüņĀüņØĖ ņśłĒøäņŚÉ ļ»Ėņ╣śļŖö ņØ╝Ļ┤ĆļÉ£ Ļ▓░Ļ│╝ļéś ĒĢ┤ņäØņØ┤ ļČĆņ×¼ĒĢ£ ņāüĒā£ņØ┤ļ®░ ņ╣©ņāśĻ┤ĆņĢöņŚÉņä£ PD-L1ņØś ļ░£Ēśäņ£©ņØ┤ ļé«Ļ▓ī Ļ┤Ćņ░░ļÉ£ļŗżļŖö ņĀÉņØä Ļ│ĀļĀżĒĢĀ ļĢī Ēśä ļŗ©Ļ│äņŚÉņä£ PD-1/PD-L1ņØä ņ╣©ņāśĻ┤ĆņĢö ĒĢŁņĢöļ®┤ņŚŁņ╣śļŻīņØś Ēæ£ņ¦Ćņ×ÉļĪ£ ņØ┤ņÜ®ĒĢśĻĖ░ņŚÉļŖö ņ¢┤ļĀżņøĆņØ┤ ņ׳ņ¢┤ ņČöĻ░ĆņĀüņØĖ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
Fig.┬Ā1.
Kaplan-Meier analysis of overall survival according to HER2 and PD-L1 expression in salivary duct carcinoma. Overall survival rates were analyzed according to HER2 expression in all cases (A). Overall survival rates were analyzed according to PD-L1 expression in all cases (B) and HER2-negative cases (C).
Table┬Ā1.
Clinicopathologic charateristics
Table┬Ā2.
Association of PD-L1 experession with various clinical parameters
References
1) Kleinsasser O, Klein HJ, Hubner G. Salivary duct carcinoma: a group of salivary gland tumors analogous to mammary duct carcinoma. Arch Klin Exp Ohren Nasen Kehlkopfheid. 1968;192:100-5.

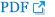
2) Jaehne M, Roeser K, Jaekel T, Schepers JD, Albert N, L├Čning T. Clinical and immunohistologic typing of salivary duct carcinoma: a report of 50 cases. Cancer. 2005;103:2526-33.


3) Limaye SA, Posner MR, Krane JF, Fonfria M, Lorch JH, Dillon DA, et al. Trastuzumab for the treatment of salivary duct carcinoma. Oncologist. 2013;18:294-300.



4) Ryu HJ, Koh YW, Yoon SO. The implications of TrkA and MET aberrations in de novo salivary duct carcinoma. Hum Pathol. 2018;81:18-25.


5) Alotaibi AM, Alqarni MA, Alnobi A, Tarakji B. Human epidermal growth factor receptor 2 (HER2/neu) in salivary gland carcinomas: a review of literature. J Clin Diagn Res. 2015;9:ZE04-8.

6) Mukaigawa T, Hayashi R, Hashimoto K, Ugumori T, Hato N, Fujii S. Programmed death ligand-1 expression is associated with poor disease free survival in salivary gland carcinomas. J Surg Oncol. 2016;114(1):36-43.


7) Chae YK, Pan A, Davis AA, Raparia K, Mohindra NA, Matsangou M, et al. Biomarkers for PD-1/PD-L1 Blockade Therapy in Non-Small-cell Lung Cancer: Is PD-L1 Expression a Good Marker for Patient Selection? Clin Lung Cancer. 2016;17(5):350-361.


8) Herbst RS, Soria JC, Kowanetz M, Fine GD, Hamid O, Gordon MS, et al. Predictive correlates of response to the anti-PD-L1 antibody MPDL3280A in cancer patients. Nature. 2014;515:563-567.



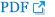
9) Kim HR, Ha SJ, Hong MH, Heo SJ, Koh YW, Choi EC, et al. PD-L1 expression on immune cells, but not on tumor cells, is a favorable prognostic factor for head and neck cancer patients. Sci Rep. 2016;6:36956.



10) Sato F, Akiba J, Kawahara A, Naito Y, Ono T, Takase Y, et al. The expression of programed death ligand-1 could be related with unfavorable prognosis in salivary duct carcinoma. J Oral Pathol Med. 2018;47(7):683-690.


11) Chang H, Kim JS, Choi YJ, Cho JG, Woo JS, Kim A, et al. Overexpression of PD-L2 is associated with shorter relapse-free survival in patients with malignant salivary gland tumors. Onco Targets Ther. 2017;10:2983-2992.



12) Harada K, Ferdous T, Ueyama Y. PD-L1 expression in malignant salivary gland tumors. BMC Cancer. 2018;18:156.



13) Haderlein M, Scherl C, Semrau S, Lettmaier S, Hecht M, Erber R, et al. Impact of postoperative radiotherapy and HER2/new overexpression in salivary duct carcinoma : a monocentric clinicopathologic analysis. Strahlenther Onkol. 2017;193:961-970.


14) Badoual C, Hans S, Merillon N, Van Ryswick C, Ravel P, Benhamouda N, et al. PD-1-expressing tumor-infiltrating T cells are a favorable prognostic biomarker in HPV-associated head and neck cancer. Cancer Res. 2013;73:128-138.


15) Tsang JY, Au WL, Lo KY, Ni YB, Hlaing T, Hu J, et al. PD-L1 expression and tumor infiltrating PD-1 + lymphocytes associated with outcome in HER2 + breast cancer patients. Breast Cancer Res Treat. 2017;162:19-30.


16) Han J, Hong Y, Lee YS. PD-L1 expression and combined status of PD-L1/PD-1-positive tumor infiltrating mononuclear cell density predict prognosis in glioblastoma patients. J Pathol Transl Med. 2017;51:40-48.


17) Thompson RH, Dong H, Lohse CM, Leibovich BC, Blute ML, Cheville JC, et al. PD-1 is expressed by tumor-infiltrating immune cells and is associated with poor outcome for patients with renal cell carcinoma. Clin Cancer Res. 2007;13:1757-1761.


18) Xu J, Sun HH, Fletcher CD, Hornick JL, Morgan EA, Freeman GJ, et al. Expression of programmed cell death 1 Ligands (PD-L1 and PD-L2) in Histiocytic and dendritic cell disorders. Am J Surg Pathol. 2016;40:443-453.








